Anvisa aprova produto de terapia avançada para tratamento de câncer

Da redação Diego Alves
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou nesta 4ª feira (26.out) o registro sanitário de um produto, de terapia avançada, para tratar pacientes adultos com Linfoma de Grandes Células B (LDGCB), recidivado ou refratário, que tenham passado por pelo menos duas linhas de terapia sistêmica. Ele se chama Yescarta e pertence à Gilead?Sciences Farmacêutica do Brasil.

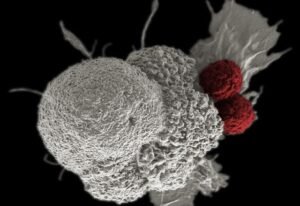
Segundo a Anvisa, é o terceiro produto de terapia avançada voltado ao tratamento de câncer aprovado e, assim como o Kymriah (tisagenlecleucel), é de terapia gênica baseada em CAR-T, células criadas em laboratório, derivadas das mais importantes do sistema de defesa do corpo humano, para identificar células cancerígenas e destruí-las.
Da submissão inicial dos documentos pela Gilead para obter o registro sanitário até a aprovação deste se passaram 258 dias. No período, foram feitas várias reuniões técnicas da agência com representantes nacionais e internacionais da companhia e houve inspeções in loco nas fábricas desta nos Estados Unidos e Holanda. A equipe da Anvisa utilizou 232 dias para analisar os dados do produto, entre os quais, por exemplo, os sobre o perfil de segurança e prova de conceito, perfil de segurança e eficácia e produção em larga escala com requisitos de qualidade e boas práticas de fabricação. O prazo das respostas ao cumprimento das exigências pela Gilead foi de 26 dias.

Conforme a autoridade sanitária nacional, “os benefícios do Yescarta são uma resposta eficiente e durável em pacientes com linfoma recidivado e refratário, sendo que as reações adversas mais comuns observadas têm boa resposta com adequado manejo clínico”. “A Anvisa comprovou, portanto, que o produto é seguro, de qualidade e que promove a eficácia pretendida, sendo os benefícios do produto superiores aos seus riscos”, complementa o comunicado da autarquia.
Para obter o registro do produto, a Gilead precisou ainda assinar um Termo de Compromisso com a agência de que enviará a esta dados obtidos em um estudo de acompanhamento de eficácia e segurança do Yescarta em longo prazo. O produto foi aprovado pela Food Drug Administration (FDA), dos Estados Unidos, em 29 de novembro de 2017. O Comitê de Medicamentos de Uso Humano (CHMP, na sigla em inglês) da European Medicines Agency (EMA) recomendou a concessão do registro sanitário em 28 de junho de 2018.

A possibilidade de o Yescarta desencadear a chamada síndrome de liberação de citocinas (SLC) — resposta sistêmica à ativação e proliferação de células CART-T — configura a principal preocupação de segurança, que a Anvisa possui, em relação ao produto. “Além disso, outros aspectos importantes de segurança são a toxicidade neurológica, citopenia prolongada e infecções graves. As estratégias de monitoramento e mitigação desses efeitos secundários são parte fundamental do plano de gerenciamento de risco definido no processo de registro na Anvisa, com medidas de responsabilização que deverão ser providenciadas para o sucesso da terapia no Brasil”, explica a autarquia.

As medidas incluem treinamento dos profissionais da saúde que farão o manejo do Yescarta e educação dedicada ao paciente e familiares com orientações pós-uso do medicamento.
Fonte: SBT News
Compartilhem, deixe seu Like






 Casal tem carro alvejado por vários tiros após sair de culto religioso em Birigui
Casal tem carro alvejado por vários tiros após sair de culto religioso em Birigui  Homem de 60 anos morre em colisão entre carro e Jeep na rodovia Assis Chateaubriand, em Braúna
Homem de 60 anos morre em colisão entre carro e Jeep na rodovia Assis Chateaubriand, em Braúna  Dois homens são baleados em ataques quase simultâneos durante a madrugada em Araçatuba
Dois homens são baleados em ataques quase simultâneos durante a madrugada em Araçatuba  Mulher fica ferida em acidente na vicinal Nicola Barbieri, em Coroados
Mulher fica ferida em acidente na vicinal Nicola Barbieri, em Coroados  GCM de Araçatuba detém homem por ato obsceno na rodoviária
GCM de Araçatuba detém homem por ato obsceno na rodoviária  Identificado corpo encontrado no rio Tietê: vítima é morador de Birigui que estava desaparecido
Identificado corpo encontrado no rio Tietê: vítima é morador de Birigui que estava desaparecido 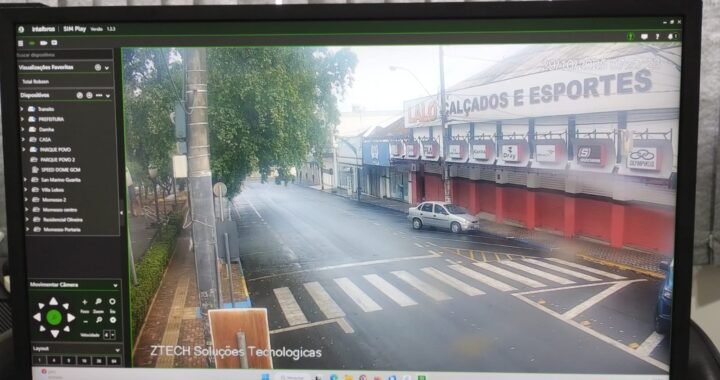 Secretaria de segurança de Birigui conclui instalação de câmeras de monitoramento em pontos estratégicos
Secretaria de segurança de Birigui conclui instalação de câmeras de monitoramento em pontos estratégicos  Criminoso que furtou bicicletas no bairro Paraíso é flagrado tentando invadir casa de idosa em Araçatuba
Criminoso que furtou bicicletas no bairro Paraíso é flagrado tentando invadir casa de idosa em Araçatuba